水の温度圧力依存性
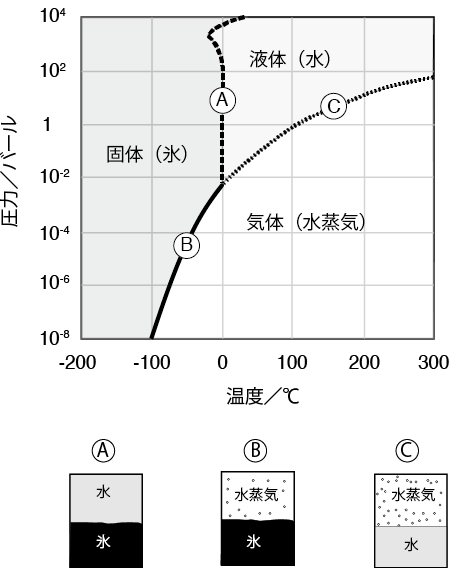
水が固体になるか、液体になるか、気体になるかは、温度と圧力で決まります。圧力が大気圧(1・013バール)だとして水の状態がどのようになるかを見てみましょう。大気圧下だと0℃以下で固体(氷)になり、0℃以上で液体になります。100℃以上になると液体から気体(水蒸気)になります。水蒸気圧が0・006バール以下では液体の水がなくなり、水は気体または固体にしかなりません。
液体の水と水蒸気が共存している状態(図のC)で水蒸気圧がどうなるかを見てみましょう。特に、100℃以上でどうなるかを見てみます。100℃以上の水の状態は地球科学や蒸気機関の研究など、さまざまな分野で重要であり、詳細に研究されています。
やかんに水を入れて熱すると、水が100℃になると沸騰し、液体の水は水蒸気になって空気中に出ていきます。30分も沸騰させておくと、やかんに入れた水はなくなります。このような例を見ると、100℃以上になると水はどんな場合でも液体から気体へと変化するように思えます。
しかし、そうならない例があります。それは圧力釜に入れた水です。圧力釜に水を入れて温度を上げると、温度を上げるにしたがい液体の水は水蒸気となるので水蒸気圧は上昇します。温度が100℃で水蒸気圧は1・014バールとなります。さらに温度を上げて125℃にします。すると、水はどんどん水蒸気なります。圧力釜の中にある水蒸気は外に出られないので、圧力釜の中の水蒸気の量は増えて圧力はどんどん高くなっていきます。圧力が2・322バールになった時に水の蒸発は止まります。125℃では2・322バールになると、液体の水がそれ以上気体にはなりません。圧力が2・322バールでは、125℃まで液体の水が安定に存在するのです。
圧力をもっとあげれば125℃以上でも液体の水が安定に存在するかもしれません。そこで、高性能圧力釜に水を入れて温度を200℃に上げます。すると、水は蒸発して圧力が15・55バールになった時点で蒸発が止まります。200℃でも液体の水は安定に存在するのです。
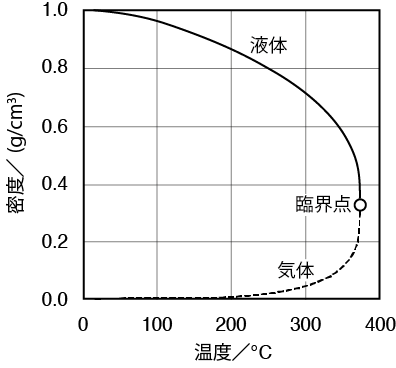
さらに温度を上げてみましょう。圧力釜の温度を350℃にして液体の水を蒸発させると、圧力が165・3バールになってようやく蒸発が止まります。350℃でも液体の水は存在します。350℃以上に温度を上げていくと、液体の密度は急激下がり、気体の密度は急激上がり、両者の密度は接近していきます。
温度を上げて373・95℃になった段階で問題が発生します。液体と気体の区別がつかなくなるのです。つまり、液体も気体も密度が等しくなるのです。このときの密度は液体も気体も0・322であり、圧力は220・6バールです。この状態を臨界点といいます。臨界点よりも温度が高くなると、液体と気体の区別がなくなります。このような状態の物質を超臨界流体といいます。水は373・95℃以上で超臨界流体となります。
じつは、超臨界状態の水は地下にはたくさんあります。通常は、1km深くなると温度が20℃から50℃ほど高くなります。100℃になる深度は、通常2kmから5kmであり、超臨界水となる深度は、7kmから18kmです。ただし、火山帯では、地表で100℃になったり、深度1kmで超臨界水となったりすることがあります。
温度上昇にともなう水の構造変化
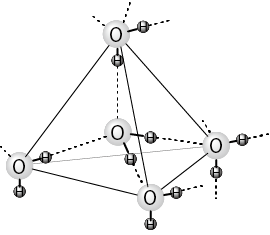
温度上昇にともない水の構造が変化する様子を見てみましょう。水は、1バールのとき0℃以下で氷という固体になっています。この固体の結晶構造を見ましょう。氷の酸素原子は、図1−10にあるように、正四面体の中心と4つの頂点にあります。そして、それぞれの酸素原子に2つの水素原子が結合して水分子ができています。水素は隣の水分子の酸素の方向にありその酸素と弱く結合しています。この結合を水素結合といいます。
1バールのとき0℃よりも温度が高くなると、氷の構造が壊れて流動性がでて液体となります。ただし、液体となっても、固体のときにあった構造が隣同士では残っています。つまり、0℃に近い水は液体であっても隣同士の配列は固体に近いのです。
さらに温度を上げてみましょう。すると、隣同士の分子の配列が少しずつ乱れていき、粘性も低くなりさらさらとしてきます。液体の水が150℃になると隣同士の配列が完全に乱れます。それでもまだ分子間の結合は臨界点である374℃くらいまでは残っています。
臨界点を超えて、超臨界流体になると分子間の結合も消えていき、500℃になると分子間結合の割合は室温下の13%程度となります。高温になると密度が高くても水はひとつひとつの分子が独立した状態になっていくのです。つまり、超臨界状態の水は、たとえ密度は液体に近くても、分子同士の結合がほとんどないという点で気体に近いのです。